ก่อนอื่นมารู้จัก และที่สำคัญต้องจำ ตารางธาตุครับ
เทคนิคการจำที่จะช่วยให้นักเรียนไม่เบื่อและจำได้ดีมีมากมายหลากหลายวิธี ที่ให้มาเป็นวิธีหนึ่งที่ช่วยให้เราจำได้ดี ได้แม่น และไม่เบื่อจ้า (ของครูก้อมีเป็นแบบเกมส์ให้เราเล่นจ้า หรือจะจำแบบไทยปนอังกฤษก้อลองดูนะ อาจจะไม่เรียงบางหมู่หรือมีไม่ครบจ้า)
หมู่ 1 LiNaK Ru Cs Fr ลินาครูซีฟราน
หมู่ 2 BaBe Mg Ca Sr Ra เบบีแมกแคลสทรอนเซียม
หมู่ 3 B Al Ga In Tl บอลอินแกลเทลเลี่ยม
หมู่ 4 C Si Ge Sn Pb ซีซิเจอทินเลด
หมู่ 5 N P As Sb Bi นะพาส
หมู่ 6 O S Se Te Po ออสซีเทลโพโลเนียม
หมู่ 7 F Cl Br I At เอฟซีแอลบีอาร์ไอ
หมู่ 8 เห็นอาร์คริปซีเรดอล He Ne Ar Kr Xe Rn
หมู่ 1 LiNaK Ru Cs Fr ลินาครูซีฟราน
หมู่ 2 BaBe Mg Ca Sr Ra เบบีแมกแคลสทรอนเซียม
หมู่ 3 B Al Ga In Tl บอลอินแกลเทลเลี่ยม
หมู่ 4 C Si Ge Sn Pb ซีซิเจอทินเลด
หมู่ 5 N P As Sb Bi นะพาส
หมู่ 6 O S Se Te Po ออสซีเทลโพโลเนียม
หมู่ 7 F Cl Br I At เอฟซีแอลบีอาร์ไอ
หมู่ 8 เห็นอาร์คริปซีเรดอล He Ne Ar Kr Xe Rn
# อย่าลืมจำแทรนสิชัน ตัวที่ 21- 30 ด้วยนะ #
@ นักเรียนสามารถเข้าศึกษาหาความรู้เรื่องต่างๆ ตามลิงค์ด้านล่าง
1. แบบจำลองอะตอม https://docs.google.com/presentation/d/
2. อะตอมและตารางธาตุ https://docs.google.com/presentation/d/
1pw_jCm2Lz02WI1xTO8vDD0KqZxTrOrYnXbz1u6M_qd4/edit?usp=sharing
พันธะไอออนิก (Ionic bond) คือแรงยึดเหนี่ยวที่เกิดในสาร โดยที่อะตอมของธาตุที่มีค่าพลังงานไอออไนเซชันต่ำ ให้เวเลนต์อิเล็กตรอนแก่อะตอมของธาตุที่มีค่าพลังงานไอออนไนเซชันสูง กลายเป็นไอออนที่มีประจุบวกและประจุลบ เมื่อไอออนทั้งสองเข้ามาอยู่ใกล้กันจะเกิดแรงดึงดูดทางไฟฟ้าที่แข็งแรงระหว่างประจุไฟฟ้าตรงข้ามเหล่านั้น ทำให้ไอออนทั้งสองยึดเหนี่ยวกันด้วย พันธะเคมีที่เรียกว่า “พันธะไอออนิก”
ตัวอย่างเช่น โครงสร้างของผลึกโซเดียมคลอไรด์เป็นของแข็ง รูปลูกบาศก์ ใสไม่มีสีในผลึก มีโซเดียมไอออนสลับกับคลอไรด์ไอออน เป็นแถว ๆ ทั้งสามมิติ มีลักษณะคล้ายตาข่าย โดยที่แตละไอออนจะมีไอออนต่างชนิดล้อมรอบอยู่ 6 ไอออน ดังรูป 2 รูป ข้างล่างดังนี้
รูปที่ 1 โครงผลึกของสารประกอบโซเดียมคลอไรด์
รูปที่ 2 แสดงไอออนในผลึก NaCl แต่ละไอออนถูกล้อมรอบด้วยไอออนตรงข้าม 6 ไอออน
เนื่องจากโลหะมีค่าพลังงานไอออไนเซชันต่ำ และอโลหะมีค่าพลังงานไอออไนเซชันสูง ดังนั้นพันธะไอออนิกจึงเกิดระหว่างธาตุโลหะ และอโลหะได้ดี กล่าวคือ อะตอมของโลหะให้เวเลนต์อิเล็กตรอนกับอะตอมของอโลหะ แล้วเกิดไอออนบวกของโลหะ และไอออนลบของอโลหะ ไอออนทั้งสองจะส่งแรงดึงดูดระหว่างประจุบวกและลบ เกิดเป็นพันธะไอออนิก และการที่โลหะให้เวเลนต์อิเล็กตรอนแก่อโลหะ เพื่อปรับให้มีเวเลนต์อิเล็กตรอนเป็นแปด แบบก๊าซเฉื่อย ส่วนอโลหะรับเวเลนต์อิเล็กตรอนมานั้นก็เพื่อปรับตัวเองให้เสถียรแบบก๊าซเฉื่อยเช่นกัน ไอออนบวกกับไอออนลบจึงดึงดูดกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้าเกิดเป็นสารประกอบไอออนิก (Ionic compound) ดังนี้
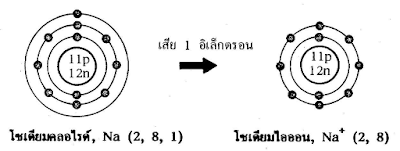
การเกิดสารประกอบโซเดียมคลอไรด์(NaCl) จากโซเดียม(Na) และ คลอรีน(Cl)
การเกิด Na+
การเกิด Cl-
การเกิดสารประกอบ NaCl
เขียนสูตรโครงสร้างแบบลิวอิส ดังนี้
แมกนีเซียมอะตอม คลอรีนอะตอม แมกนีเซียมคลอไรด์
ตัวอย่างการเกิดพันธะไอออนิกในสารประกอบต่าง ๆ
2 , 8 , 18 , 18 , 8 , 2 2 , 6 2, 8 , 18 , 18 , 8 2 , 8
Ba O Ba2+ O2-
ลักษณะสำคัญของสารประกอบไอออนิก
1. พันธะไอออนิก เป็นพันธะเคมีที่เกิดจาก ไอออนของโลหะ + ไอออนของอโลหะ เช่น NaCl , MgO , KI แต่อะตอมของโลหะบางชนิด เช่น Al , Be , Hg สามารถสร้างพันธะโคเวเลนต์กับอะตอมของโลหะได้ เช่น Al2Cl6 , BeF2 , BeCl2 , HgCl2 เป็นสารประกอบโคเวเลนต์แต่ Al2O3 , Hg2Cl2 เป็นสารประกอบไอออนิก
2. พันธะไอออนิก อาจเป็นพันธะเคมีที่เกิดจากธาตุที่มีพลังงานไอออไนเซชันต่ำรวมกับธาตุที่มีพลังงานไอออไนเซชันสูง
3.พันธะไออนิกอาจเป็นพันธะเคมีที่เกิดจากไอออนบวกที่เป็นกลุ่มอะตอมของอโลหะ เช่น NH4+ กับไอออนลบของอโลหะ เช่น
1. พันธะไอออนิก เป็นพันธะเคมีที่เกิดจาก ไอออนของโลหะ + ไอออนของอโลหะ เช่น NaCl , MgO , KI แต่อะตอมของโลหะบางชนิด เช่น Al , Be , Hg สามารถสร้างพันธะโคเวเลนต์กับอะตอมของโลหะได้ เช่น Al2Cl6 , BeF2 , BeCl2 , HgCl2 เป็นสารประกอบโคเวเลนต์แต่ Al2O3 , Hg2Cl2 เป็นสารประกอบไอออนิก
2. พันธะไอออนิก อาจเป็นพันธะเคมีที่เกิดจากธาตุที่มีพลังงานไอออไนเซชันต่ำรวมกับธาตุที่มีพลังงานไอออไนเซชันสูง
3.พันธะไออนิกอาจเป็นพันธะเคมีที่เกิดจากไอออนบวกที่เป็นกลุ่มอะตอมของอโลหะ เช่น NH4+ กับไอออนลบของอโลหะ เช่น
4. สารประกอบไอออนิกไม่มีสูตรโมเลกุล มีแต่สูตรเอมพิริกัล
5. สารประกอบไอออนิกมีจุดเดือด จุดหลอมเหลวสูง เช่น NaCl จุดหลอมเหลว 8010C
6. สารประกอบไอออนิกในภาวะปกติเป็นของแข็ง ประกอบด้วยไอออนบวก และไอออนลบ ไอออนเหล่านี้ไม่เคลื่อนที่ ดังนั้นจึงไม่นำไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้ำ จะแตกตัวเป็นไอออนเคลื่อนที่ได้ เกิดเป็นสารอิเล็กโทรไลต์จึงสามารถนำไฟฟ้าได้
7. สารประกอบไอออนิกชนิดที่ละลายน้ำได้ จะต้องมีการเปลี่ยนแปลงพลังงานเกิดขึ้นเสมอ อาจเป็นแบบคายหรือดูดพลังงาน เช่น KCl 1 โมล ละลายน้ำ ดูดพลังงาน = 17 kJ/mol
8.สารประกอบไอออนิกที่เกิดจากอะตอมโลหะกับอะตอมอโลหะ สร้างเฉพาะพันธะไอออนิกอย่างเดียว เช่น NaCl , MgCl2 , K2S , CaO
5. สารประกอบไอออนิกมีจุดเดือด จุดหลอมเหลวสูง เช่น NaCl จุดหลอมเหลว 801
6. สารประกอบไอออนิกในภาวะปกติเป็นของแข็ง ประกอบด้วยไอออนบวก และไอออนลบ ไอออนเหล่านี้ไม่เคลื่อนที่ ดังนั้นจึงไม่นำไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้ำ จะแตกตัวเป็นไอออนเคลื่อนที่ได้ เกิดเป็นสารอิเล็กโทรไลต์จึงสามารถนำไฟฟ้าได้
7. สารประกอบไอออนิกชนิดที่ละลายน้ำได้ จะต้องมีการเปลี่ยนแปลงพลังงานเกิดขึ้นเสมอ อาจเป็นแบบคายหรือดูดพลังงาน เช่น KCl 1 โมล ละลายน้ำ ดูดพลังงาน = 17 kJ/mol
8.สารประกอบไอออนิกที่เกิดจากอะตอมโลหะกับอะตอมอโลหะ สร้างเฉพาะพันธะไอออนิกอย่างเดียว เช่น NaCl , MgCl2 , K2S , CaO

9.สารประกอบไอออนิกที่เกิดจากโลหะหรือกลุ่มอะตอมอโลหะที่เกิดไอออนบวกกับอโลหะ หรือกลุ่มอะตอมอโลหะที่เป็นไอออนลบ สารพวกนี้จะมีทั้งพันธะไอออนิก และพันธะโคเวเลนต์ เช่น CaCO3 , NH4Cl , CaCO3 มีพันธะไอออนิกระหว่างไอออนบวกคือ Ca2+ กับไอออนลบคือ [CO3]2- และมีพันธะโคเวเลนต์ในส่วนที่เป็นไอออนลบคือ [CO3]2- ดังนี้
NH4Cl มีพันธะไอออนิกระหว่างไอออนบวกคือ NH4+ กับไอออนลบคือ Cl- และมีพันธะโคเวเลนต์ในส่วนที่เป็นไอออนบวกคือ [NH4]+ ดังนี้

โครงสร้างของสารประกอบไอออนิก
ผลึกสารประกอบไอออนิกมีรูปทรงเป็นรูปลูกบาศก์ประกอบด้วยไอออนบวกและไอออนลบเรียงสลับกันเป็นสามมิติแบบต่าง ๆ ไม่สามารถแยกเป็นโมเลกุลเดี่ยว ๆ ได้ ดังนั้นจึงไม่สามารถทราบขอบเขตของไอออนของธาตุต่าง ๆ ใน 1 โมเลกุลได้ แต่สามารถหาออกมาได้ในรูปอัตราส่วนอย่างต่ำของไอออนที่เป็นองค์ประกอบเท่านั้น จึงมีแต่สูตรอย่างง่าย(สูตรเอมพิริกัล) ไม่มีสูตรโมเลกุล จึงใช้สูตรอย่างง่ายแทนสูตรเคมีของสารประกอบไอออนิก
โครงสร้างผลึกสารประกอบไอออนิกจะเป็นแบบใด ขึ้นอยู่กับ
· ประจุที่ปรากฏอยู่บนไอออนบวก และลบ
· อัตราส่วนระหว่างรัศมีไอออนบวกและลบ
ตัวอย่างโครงสร้างของสารประกอบไอออนิกอื่น ๆ ที่เกิดจากไอออนบวก และไอออนลบในลักษณะเดียวกับผลึกโซเดียมคลอไรด์ แต่มีการจัดตัวแตกต่างกัน ดังรูป
รูป แสดงผลึกของสารประกอบไอออนิกแบบต่าง ๆ
1.
โครงสร้างของสารประกอบไอออนิกมีลักษณะคล้ายตาข่าย ไม่มีสูตรโมเลกุล มีแต่สูตรอย่างง่าย
2.
โครงผลึกของสารประกอบไอออนิกของธาตุหมู่เดียว
อาจจะเหมือนกันหรือไม่เหมือนกันก็ได้ เช่น โครงผลึกของ NaCl
ต่างจากโครงผลึกของ CSCl ซึ่งทั้งคู่ต่างก็เป็นคลอไรด์ของธาตุหมู่เดียวกัน
Link : ความรู้แบบจำลองอะตอม https://www.scimath.org/lesson-chemistry/item/7121-atomic-model
LinK : ธาตุกัมมันตรังสี https://www.scimath.org/lesson-chemistry/item/7085-2017-05-28-03-07-00
รังสีบีตาหรืออนุภาคบีตา สัญลักษณ์
รังสีแกมมา สัญลักษณ์
Link : ความรู้แบบจำลองอะตอม https://www.scimath.org/lesson-chemistry/item/7121-atomic-model
LinK : ธาตุกัมมันตรังสี https://www.scimath.org/lesson-chemistry/item/7085-2017-05-28-03-07-00
ธาตุกัมมันตรังสี ในปี พ.ศ. 2439 อองตวน อองรี เม็กเคลเรล นักวิทยาศาสตร์ชาวฝรั่งเศสได้ค้นพบว่าแผ่นฟิล์มถ่ายรูปที่ห่อหุ้มด้วยกระดาษดำและเก็บรวมไว้กับสารประกอบของยูเรเนียม จะมีลักษณะเหมือนถูกแสงสว่าง เขาจึงได้ทดลองเก็บแผ่นฟิล์มกับสารประกอบยูเรเนียมชนิดอื่นๆดูบ้าง ซึ่งก็พบว่าผลที่เกิดขึ้นเป็นเช่นเดิม ดังนั้นเขาจึงสรุปธาตุยูเรเนียมมีสมบัติในการแผ่รังสีออกมาได้
หลังจากนั้นปีแอร์ คูรี และ มารี คูรี ได้พบเพิ่มเติมว่า ยังมีธาตุอื่นๆที่สามารถแผ่รังสีได้เช่นเดียวกับยูเรเนียม ซึ่งต่อมานักวิทยาศาสตร์ได้เรียกรังสีที่แผ่ออกมาว่า กัมมันตภาพรังสี และเรียกธาตุต่างๆที่มีคุณสมบัติแผ่รังสีว่า "ธาตุกัมมันตรังสี"
ความหมายของธาตุกัมมันตรังสี
ธาตุกัมมันตรังสี
หมายถึงธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียร
เป็นธาตุที่มีเลขอะตอมสูงกว่า 82 ( ยกเว้น C-14 )กัมมันตภาพรังสี
หมายถึงปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว
มี 3 ชนิด
คือ รังสีแอลฟา รังสีบีตา และรังสีแกมมาในนิวเคลียสของธาตุประกอบด้วยโปรตอนซึ่ง
มีประจุบวกและนิวตรอนซึ่งเป็นกลางทางไฟฟ้า สัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร
ธาตุนั้นจึงปล่อยรังสีออกมาเพื่อปรับตัวเองให้เสถียร ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ
เช่น
ชนิดและสมบัติของรังสีบางชนิด
หลังจากนั้นปีแอร์ คูรี และ มารี คูรี ได้พบเพิ่มเติมว่า ยังมีธาตุอื่นๆที่สามารถแผ่รังสีได้เช่นเดียวกับยูเรเนียม ซึ่งต่อมานักวิทยาศาสตร์ได้เรียกรังสีที่แผ่ออกมาว่า กัมมันตภาพรังสี และเรียกธาตุต่างๆที่มีคุณสมบัติแผ่รังสีว่า "ธาตุกัมมันตรังสี"
ความหมายของธาตุกัมมันตรังสี ธาตุกัมมันตรังสี หมายถึงธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียร เป็นธาตุที่มีเลขอะตอมสูงกว่า 82 ( ยกเว้น C-14 )กัมมันตภาพรังสี หมายถึงปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว มี 3 ชนิด คือ รังสีแอลฟา รังสีบีตา และรังสีแกมมาในนิวเคลียสของธาตุประกอบด้วยโปรตอนซึ่ง มีประจุบวกและนิวตรอนซึ่งเป็นกลางทางไฟฟ้า สัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร ธาตุนั้นจึงปล่อยรังสีออกมาเพื่อปรับตัวเองให้เสถียร ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ เช่น



















ไม่มีความคิดเห็น:
แสดงความคิดเห็น